Spis treści dla tego artykułu:
1. Rozwój aminokwasów
2. Właściwości strukturalne
3. Skład chemiczny
4. Klasyfikacja
5. Synteza
6. Właściwości fizykochemiczne
7. Toksyczność
8. Aktywność przeciwdrobnoustrojowa
9. Właściwości reologiczne
10. Zastosowania w branży kosmetycznej
11. Zastosowania w codziennych kosmetykach
Aminokwasowe środki powierzchniowo czynne (AA)są klasą środków powierzchniowo czynnych utworzonych przez połączenie grup hydrofobowych z jednym lub więcej aminokwasami. W tym przypadku aminokwasy mogą być syntetyczne lub wyprowadzane z hydrolizatów białkowych lub podobnych źródeł odnawialnych. Niniejszy artykuł obejmuje szczegóły większości dostępnych syntetycznych tras AA i wpływ różnych dróg na właściwości fizykochemiczne produktów końcowych, w tym rozpuszczalność, stabilność dyspersji, toksyczność i biodegradowalność. Jako klasa środków powierzchniowo czynnych w rosnącym popycie, wszechstronność AA ze względu na ich zmienną strukturę oferuje dużą liczbę możliwości komercyjnych.
Biorąc pod uwagę, że środki powierzchniowo czynne są szeroko stosowane w detergentach, emulgatory, inhibitory korozji, trzeciorzędowym odzyskiwaniu oleju i farmaceutyce, naukowcy nigdy nie przestali zwracać uwagi na środki powierzchniowo czynne.
Środki powierzchniowo czynne są najbardziej reprezentatywnymi produktami chemicznymi, które są codziennie spożywane w dużych ilościach na całym świecie i miały negatywny wpływ na środowisko wodne.Badania wykazały, że powszechne stosowanie tradycyjnych środków powierzchniowo czynnych może mieć negatywny wpływ na środowisko.
Obecnie nietoksyczność, biodegradowalność i biokompatybilność są prawie tak samo ważne dla konsumentów, jak użyteczność i wydajność środków powierzchniowo czynnych.
Biosurfaktanty to przyjazne dla środowiska zrównoważone środki powierzchniowo czynne, które są naturalnie syntetyzowane przez mikroorganizmy, takie jak bakterie, grzyby i drożdże lub wydzielane zewnątrzkomórkowo.Dlatego biosurfaktanty można również przygotować za pomocą projektu molekularnego do naśladowania naturalnych struktur amfifilowych, takich jak fosfolipidy, glikozydy alkilowe i aminokwasy acylowe.
Aminokwasowe środki powierzchniowo czynne (AA)są jednym z typowych środków powierzchniowo czynnych, zwykle wytwarzanych z surowców pochodzących z zwierząt lub rolnictwa. W ciągu ostatnich dwóch dekad AA wzbudziły duże zainteresowanie naukowców jako nowych środków powierzchniowo czynnych, nie tylko dlatego, że mogą być zsyntetyzowane z zasobów odnawialnych, ale także dlatego, że AA są łatwo degradowalne i mają nieszkodliwe produkty uboczne, co czyni je bezpieczniejszymi dla środowiska.
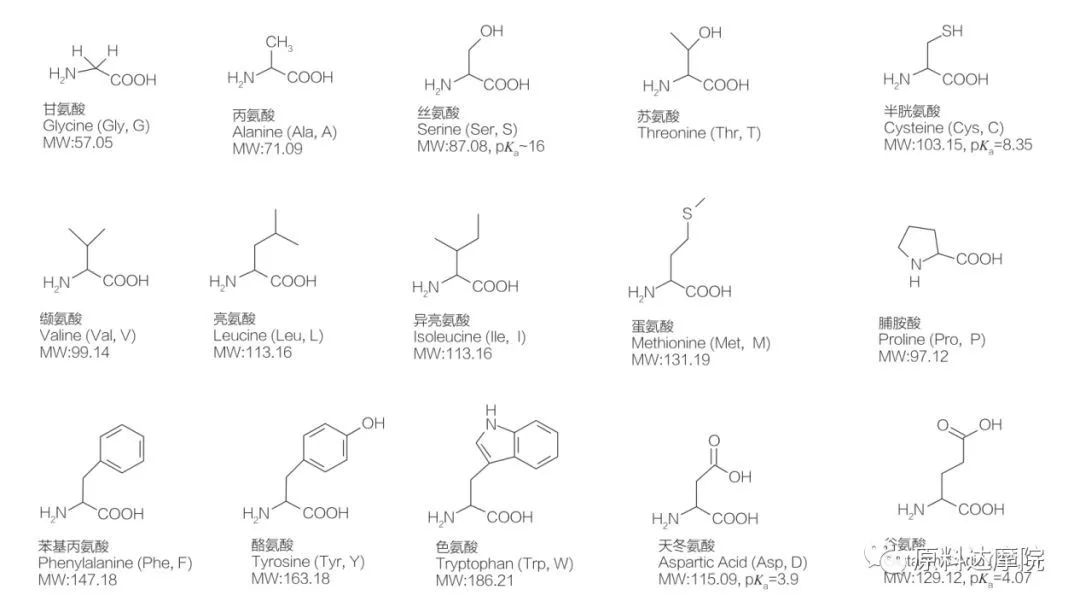
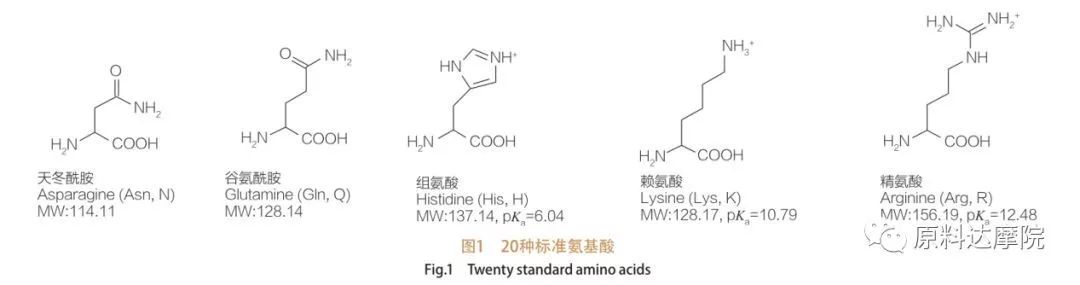
AA można zdefiniować jako klasę środków powierzchniowo czynnych składających się z aminokwasów zawierających grupy aminokwasowe (HO 2 C-Chr-NH 2) lub reszt aminokwasowych (HO 2 C-chr-NH-). 2 funkcjonalne regiony aminokwasów pozwalają na wyprowadzenie szerokiej gamy środków powierzchniowo czynnych. W naturze istnieje 20 standardowych aminokwasów proteinogennych i jest odpowiedzialnych za wszystkie reakcje fizjologiczne w aktywności wzrostu i życia. Różnią się od siebie tylko w zależności od pozostałości R (ryc. 1, PK A jest ujemnym logarytmem stałej dysocjacji kwasu roztworu). Niektóre są niepolarne i hydrofobowe, niektóre są polarne i hydrofilowe, niektóre są podstawowe, a niektóre kwaśne.
Ponieważ aminokwasy są związkami odnawialnymi, środki powierzchniowo czynne syntetyzowane z aminokwasów mają również duży potencjał, aby stać się zrównoważonym i przyjaznym dla środowiska. Prosta i naturalna struktura, niska toksyczność i szybka biodegradowalność często czynią je lepszymi od konwencjonalnych środków powierzchniowo czynnych. Stosując odnawialne surowce (np. Aminokwasy i oleje roślinne), AA mogą być wytwarzane przez różne trasy biotechnologiczne i trasy chemiczne.
Na początku XX wieku odkryto po raz pierwszy jako substraty syntezy środków powierzchniowo czynnych.AAS stosowano głównie jako konserwatywy w preparatach farmaceutycznych i kosmetycznych.Ponadto stwierdzono, że AA są biologicznie aktywne przeciwko różnorodnym bakteriom, guzom i wirusom powodującym chorobę. W 1988 r. Dostępność tanich AAS generowała zainteresowanie badaniami aktywnością powierzchniową. Dzisiaj, wraz z rozwojem biotechnologii, niektóre aminokwasy mogą być również zsyntetyzowane komercyjnie na dużą skalę przez drożdże, co pośrednio dowodzi, że produkcja AAS jest bardziej przyjazna dla środowiska.
01 Rozwój aminokwasów
Już na początku XIX wieku, kiedy po raz pierwszy odkryto naturalnie aminokwasy, ich struktury będą niezwykle cenne - użyteczne jako surowce do przygotowania amfifli. Pierwsze badanie o syntezie AAS zostało zgłoszone przez Bondi w 1909 r.
W tym badaniu n-acylglicyna i n-acylalanina wprowadzono jako grupy hydrofilowe dla środków powierzchniowo czynnych. Późniejsze prace obejmowały syntezę lipoaminokwasów (AA) przy użyciu glicyny i alaniny oraz Hentrich i in. opublikował serię ustaleń,w tym pierwsza aplikacja patentowa, w stosunku do sarkosinianu acylowego i acylu asparaginianu jako środków powierzchniowo czynnych w produktach czyszczących gospodarstw domowych (np. Szampony, detergenty i pasty do zębów).Następnie wielu badaczy zbadało syntezę i właściwości fizykochemiczne aminokwasów acylowych. Do tej pory opublikowano dużą literaturę na temat syntezy, nieruchomości, zastosowań przemysłowych i biodegradowalności AA.
02 Właściwości strukturalne
Niepolarne hydrofobowe łańcuchy kwasów tłuszczowych AA mogą różnić się strukturą, długością łańcucha i liczby.Różnorodność strukturalna i wysoka aktywność powierzchni AA wyjaśniają ich szeroką różnorodność kompozycyjną oraz właściwości fizykochemiczne i biologiczne. Grupy główne AA składają się z aminokwasów lub peptydów. Różnice w grupach głównych określają adsorpcję, agregację i aktywność biologiczną tych środków powierzchniowo czynnych. Grupy funkcjonalne w grupie głównej określają rodzaj AA, w tym kationowe, anionowe, niejonowe i amfoteryczne. Połączenie hydrofilowych aminokwasów i hydrofobowych długich łańcuchów tworzy strukturę amfifilową, która sprawia, że cząsteczka jest aktywna. Ponadto obecność asymetrycznych atomów węgla w cząsteczce pomaga tworzyć cząsteczki chiralne.
03 Skład chemiczny
Wszystkie peptydy i polipeptydy są produktami polimeryzacji tych prawie 20 α-proteinogennych α-aminokwasów. Wszystkie 20 α-aminokwasy zawierają grupę funkcjonalną kwasu karboksylowego (-COOH) i grupę funkcjonalną aminową (-NH 2), oba przyłączone do tego samego tetraedrycznego atomu α-węglowego. Aminokwasy różnią się od siebie różnymi grupami R przyłączonymi do węgla α (z wyjątkiem licyny, gdzie grupa R jest wodór.) Grupy R mogą różnić się strukturą, wielkością i ładunkiem (kwasowość, alkaliczność). Różnice te określają również rozpuszczalność aminokwasów w wodzie.
Aminokwasy są chiralne (z wyjątkiem glicyny) i są optycznie aktywne z natury, ponieważ mają cztery różne podstawy powiązane z węglem alfa. Aminokwasy mają dwa możliwe konformacje; Są to, że są to siebie nawzajem, pomimo faktu, że liczba L-stereoizomerów jest znacznie wyższa. Grupa R obecna w niektórych aminokwasach (fenyloalanina, tyrozyna i tryptofan) jest aryl, co prowadzi do maksymalnej absorpcji UV przy 280 nm. Kwaśny α-COOH i podstawowy α-NH 2 w aminokwasach są zdolne do jonizacji, a oba stereoizomery, którekolwiek z nich są, konstruują równowagę jonizacji pokazaną poniżej.
R-COOH ↔R-COO-+ h+
R-NH3+↔R-NH2+ h+
Jak pokazano w powyższym równowadze jonizacji, aminokwasy zawierają co najmniej dwie słabe kwaśne grupy; Jednak grupa karboksylowa jest znacznie bardziej kwaśna w porównaniu z protonowaną grupą aminową. PH 7,4, grupa karboksylowa jest deprotonowana, podczas gdy grupa aminowa jest protonowana. Aminokwasy z nieonizowanymi grupami R są neutralne elektrycznie przy tym pH i formie zitterion.
04 Klasyfikacja
AA można sklasyfikować zgodnie z czterema kryteriami, które z kolei opisano poniżej.
4.1 Według pochodzenia
| Zgodnie z pochodzeniem AA można podzielić na 2 kategorie w następujący sposób. ① Naturalna kategoria Niektóre naturalnie występujące związki zawierające aminokwasy również mają zdolność zmniejszania napięcia powierzchniowego/międzyfazowego, a niektóre nawet przekraczają skuteczność glikolipidów. Te AA są również znane jako lipopeptydy. Lipopeptydy to związki o niskiej masie cząsteczkowej, zwykle wytwarzane przez gatunki Bacillus.
Takie AA są dalej podzielone na 3 podklasy:surfactin, iturin i fengycyna.
|
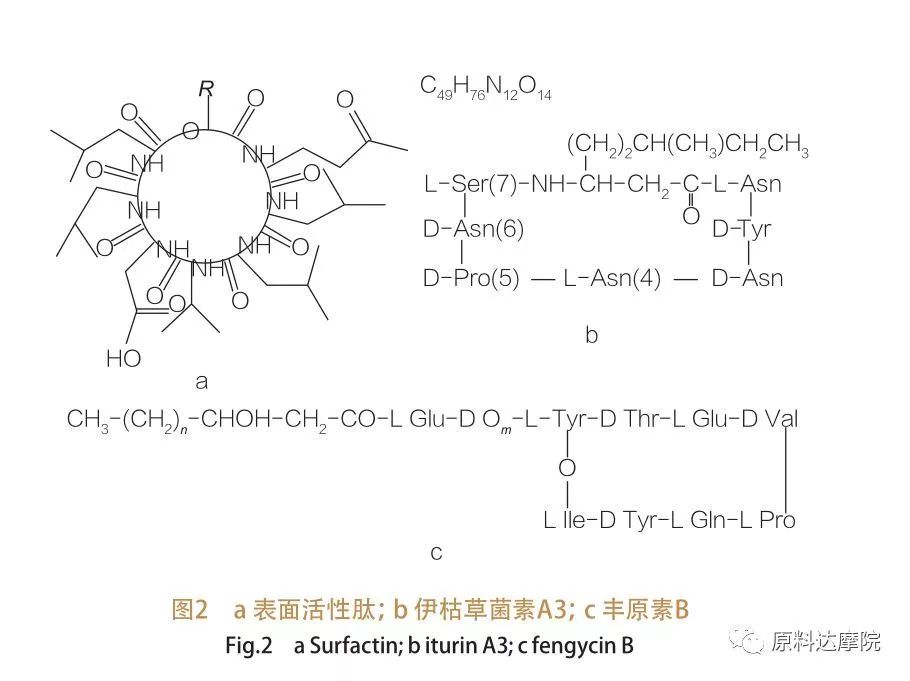
| Rodzina powierzchniowo aktywnych peptydów obejmuje warianty heptapeptydu różnych substancji,Jak pokazano na rycinie 2A, w którym łańcuch nienasycony C12-C16 β-hydroksy tłuszczowy jest powiązany z peptydem. Peptyd powierzchniowo-aktywny jest makrocyklicznym laktonem, w którym pierścień jest zamknięty przez kataliza między C-końcowym kwasu β-hydroksy tłuszczowego a peptydem. W podklasie ituryny znajduje się sześć głównych wariantów, a mianowicie ituryna A i C, mykosubtilina i baxillomycyna D, F i L.We wszystkich przypadkach heptapeptydy są powiązane z łańcuchami C14-C17 kwasów tłuszczowych β-aminowych (łańcuchy mogą być zróżnicowane). W przypadku ekurimycyny grupa aminowa w pozycji β może tworzyć wiązanie amidowe z C-końcowym, tworząc w ten sposób makrocykliczną strukturę laktamu.
Podklasa fengycyna zawiera fengycynę A i B, które są również nazywane plipastatyną, gdy Tyr9 jest skonfigurowany D.Dekapeptyd jest powiązany z nasyconym lub nienasyconym łańcuchem kwasu tłuszczowego C14 -C18. Strukturalnie plipastatyna jest również makrocyklicznym laktonem, zawierającym łańcuch boczny Tyr w pozycji 3 sekwencji peptydowej i tworząc wiązanie estra z resztą C-końcową, tworząc w ten sposób wewnętrzną strukturę pierścienia (podobnie jak w przypadku wielu lipopeptydów pseudomonas).
② Kategoria syntetyczna AA można również zsyntetyzować za pomocą dowolnego z kwasowych, podstawowych i neutralnych aminokwasów. Typowymi aminokwasami stosowanymi do syntezy AA są kwas glutaminowy, seryna, prolina, kwas asparaginowy, glicyna, arginina, alanina, leucyna i białko hydrolizaty. Ta podklasa środków powierzchniowo czynnych można wytwarzać metodami chemicznymi, enzymatycznymi i chemoenzymatycznymi; Jednak w przypadku produkcji AA synteza chemiczna jest bardziej ekonomicznie wykonalna. Wspólne przykłady to kwas N-Lauroyl-L-glutaminowy i kwas N-palmitoilo-L-glutaminowy.
|
4.2 Na podstawie podstawników łańcucha alifatycznego
Na podstawie podstawników łańcucha alifatycznego, środki powierzchniowo czynne na bazie aminokwasów można podzielić na 2 typy.
Zgodnie z pozycją podstawnika
| ①n-podstawione aa W związkach N-podstawionych grupa aminowa zastępuje grupa lipofilowa lub grupa karboksylowa, co powoduje utratę zasad. Najprostszym przykładem AA podstawionych N-Acyl są aminokwasy N-Acyl, które są zasadniczo anionowymi środkami powierzchniowo czynnymi. N-podstawione AA mają wiązanie amidowe przymocowane między częściami hydrofobowymi i hydrofilowymi. Wiązanie amidowe ma zdolność tworzenia wiązania wodorowego, co ułatwia degradację tego środka powierzchniowo czynnego w środowisku kwaśnym, czyniąc w ten sposób biodegradowalny.
②c-podstawione AA W związkach C-podstawionych zastępowanie występuje w grupie karboksylowej (poprzez wiązanie amidowe lub estrowe). Typowe związki C-podstawione C (np. Estry lub amidy) to zasadniczo kationowe środki powierzchniowo czynne.
③n- i podstawione AA W tego rodzaju środka powierzchniowo czynnego zarówno grupy aminowe, jak i karboksylowe są częścią hydrofilową. Ten typ jest zasadniczo amfoterycznym środkiem powierzchniowo czynnym. |
4.3 zgodnie z liczbą hydrofobowych ogonów
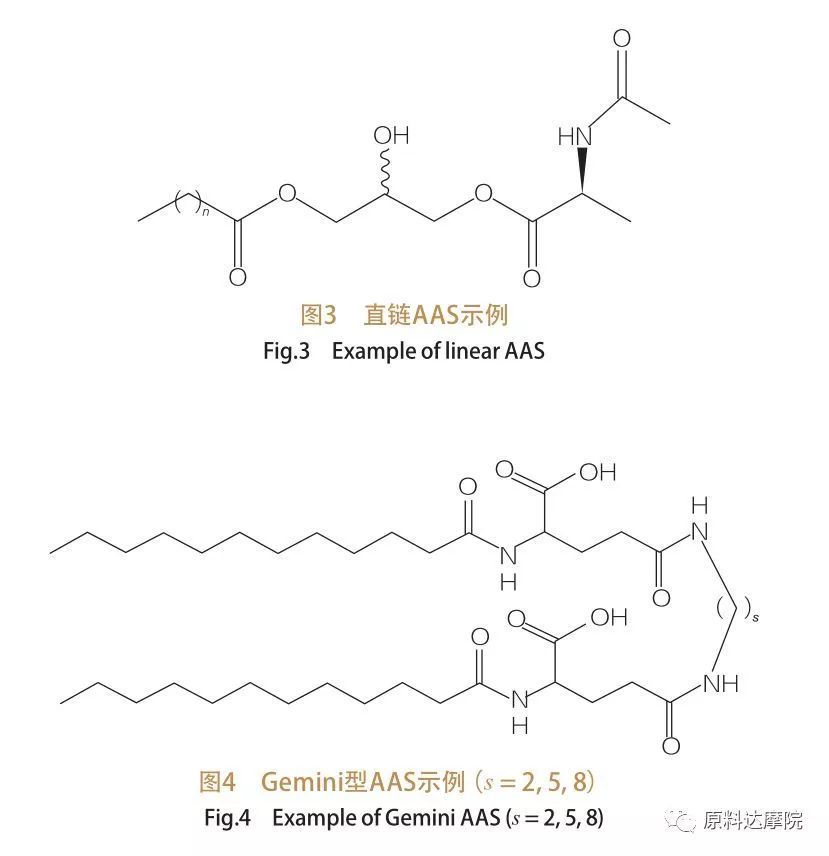
W oparciu o liczbę grup głowy i hydrofobowych ogonów AA można podzielić na cztery grupy. AAS prostego łańcucha, typu AAS, typu glicerolipidów AAS i bicefaliczny typ AAS. Surfaktanty o prostym łańcuchu są środkami powierzchniowo czynnymi składającymi się z aminokwasów z tylko jednym hydrofobowym ogonem (ryc. 3). Bliźnięta AA mają dwie grupy polarne aminokwasowe i dwa hydrofobowe ogony na cząsteczkę (ryc. 4). W tego typu strukturze dwa proste łańcuch AA są połączone przez przekładkę i dlatego są również nazywane dimerami. Z drugiej strony w AA typu glicerolipidów dwa hydrofobowe ogony są przymocowane do tej samej grupy głowy aminokwasów. Te środki powierzchniowo czynne można uznać za analogi monoglicerydów, diglicerydów i fosfolipidów, podczas gdy w AA typu bola dwie grupy aminokwasowe są połączone hydrofobowym ogonem.
4.4 Według rodzaju grupy głównej
① Cationic AAS
Grupa główna tego rodzaju środka powierzchniowo czynnego ma ładunek dodatni. Najwcześniejszym kationowym AAS jest arginat etylowy kokoylowy, który jest karboksylanem pirolidonu. Unikalne i różnorodne właściwości tego środka powierzchniowo czynnego sprawiają, że jest użyteczny w środkach dezynfekujących, środkach przeciwdrobnoustrojowych, środkach antystatycznych, odżywkach włosów, a także delikatnych na oczach i skórze i łatwo biodegradowalnym. Singre i Mhatre zsyntetyzowali kationowe AA na bazie argininy i ocenili ich właściwości fizykochemiczne. W tym badaniu twierdzili, że wysokie plony produktów uzyskane przy użyciu warunków reakcji Schotten-Baumann. Wraz ze wzrostem długości łańcucha alkilowego i hydrofobowością stwierdzono, że aktywność powierzchniowa środka powierzchniowo czynnego wzrasta, a stężenie krytycznego miceli (CMC) zmniejsza się. Kolejnym jest czwartorzędowe białko acylowe, które jest powszechnie stosowane jako odżywka w produktach do pielęgnacji włosów.
②anionic AAS
W anionowych środkach powierzchniowo czynnych grupa głowy środka powierzchniowo czynnego ma ładunek ujemny. Sarkozyna (CH 3 -NH -CH2 -COOH, N -metyloglicyna), aminokwas powszechnie występujący w jeżowcach morskich i gwiazdach morskich, jest chemicznie związany z glicyną (NH 2 -COOH,), podstawowym aminokwasem występującym w komórkach ssaków. -Cooh) jest chemicznie związany z glicyną, która jest podstawowym aminokwasem występującym w komórkach ssaków. Kwas laurynowy, kwas tetradekanowy, kwas oleinowy oraz ich halogendy i estry są powszechnie stosowane do syntezy środków powierzchniowo czynnych. Sarkozynany są z natury łagodne i dlatego są powszechnie stosowane w płynach jamy ustnej, szamponach, piankach do golenia, filtry przeciwsłonecznej, środkach czyszczących skóry i innych produktach kosmetycznych.
Inne dostępne w handlu anionowym AA obejmują odpowiednio Amisoft CS-22 i AMILITEGCK-12, które są nazwami handlowymi dla glicynianu N-kokoilo-L-glicynianu i potasu. Amilite jest powszechnie stosowany jako środek pieniący, detergent, rozpuszczenie, emulgator i dyspergator, i ma wiele zastosowań w kosmetykach, takich jak szampony, mydła do kąpieli, mycie ciała, pasty do zębów, środki czyszczące, mydła oczyszczające, kontaktowe soczewki. Amisoft jest używany jako łagodny środek czyszczący skóry i włosów, głównie w środkach do czyszczenia twarzy i ciała, blokujących syntetyczne detergenty, produkty do pielęgnacji ciała, szampony i inne produkty do pielęgnacji skóry.
③zwitterionic lub amfoteryczne AA
Amfoteryczne środki powierzchniowo czynne zawierają zarówno kwasowe, jak i podstawowe miejsca, a zatem mogą zmienić ładunek poprzez zmianę wartości pH. W mediach alkalicznych zachowują się jak anionowe środki powierzchniowo czynne, podczas gdy w środowiskach kwaśnych zachowują się jak kationowe środki powierzchniowo czynne i w neutralnych pożywkach, takich jak amfoteryczne środki powierzchniowo czynne. Laurylowa lizyna (LL) i alkoksy (2-hydroksypropylo) arginina są jedynymi znanymi amfoterycznymi środkami powierzchniowo czynnymi opartymi na aminokwasach. LL jest produktem kondensacji lizyny i kwasu laurynowego. Ze względu na swoją strukturę amfoteryczną LL jest nierozpuszczalne u prawie wszystkich rodzajów rozpuszczalników, z wyjątkiem rozpuszczalników bardzo alkalicznych lub kwaśnych. Jako proszek organiczny LL ma doskonałą przyczepność do powierzchni hydrofilowych i niski współczynnik tarcia, zapewniając doskonałą zdolność smarowania środków powierzchniowo czynnych. LL jest szeroko stosowany w kremach skóry i odżywkach do włosów, a także jest stosowany jako smar.
④Nonionic AAS
Niejonowe środki powierzchniowo czynne charakteryzują się polarnymi grupami głowy bez formalnych opłat. Osiem nowych etoksylowanych niejonowych środków powierzchniowo czynnych przygotowano przez Al-Sabagh i in. z rozpuszczalnych w oleju α-aminokwasów. W tym procesie L-fenyloalanina (LEP) i L-leucyna najpierw esteryfikowano heksadekanolem, a następnie pochylono kwasem palmitynowym, aby dać dwa amidy i dwa estry α-aminokwasów. Następnie amidy i estry przeszły reakcje kondensacyjne z tlenkiem etylenu w celu przygotowania trzech pochodnych fenyloalaniny o różnej liczbie jednostek polioksyetylenu (40, 60 i 100). Stwierdzono, że te niejonowe AA mają dobre właściwości detergencyjne i pieniące.
05 Synteza
5.1 Podstawowa trasa syntetyczna
W AA grupy hydrofobowe mogą być przyłączone do miejsc aminy lub kwasu karboksylowego lub przez łańcuchy boczne aminokwasów. Na tej podstawie dostępne są cztery podstawowe drogi syntetyczne, jak pokazano na rycinie 5.
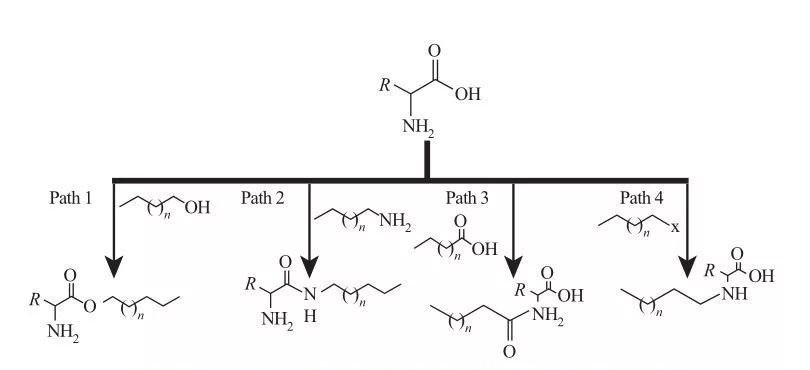
Ryc. 5 Podstawowe ścieżki syntezy surfaktantów na bazie aminokwasów
| Ścieżka 1. Amfifilowe aminy estrowe są wytwarzane przez reakcje estryfikacyjne, w którym to przypadku synteza środków powierzchniowo czynnych jest zwykle osiąga się przez refluksowanie alkoholi tłuszczowej i aminokwasów w obecności środka odwodnienia i kwaśnego katalizatora. W niektórych reakcjach kwas siarkowy działa zarówno jako katalizator, jak i środek odwodniowy.
Ścieżka 2. Aktywowane aminokwasy reagują z alkiloaminami z tworzeniem wiązań amidowych, co powoduje syntezę amfifilowych amidoamin.
Ścieżka 3. Amido kwasów syntetyzuje się poprzez reakcję grup aminowych aminokwasów za pomocą kwasów amido.
Ścieżka 4. Długo łańcuchowe aminokwasy alkilowe zsyntetyzowano przez reakcję grup aminowych z haloalanami. |
5.2 Postępy w syntezie i produkcji
5.2.1 Synteza środków powierzchniowo czynnych aminokwasowych/peptydowych
N-Acyl lub aminokwasy lub peptydy o-acyl można syntetyzować przez katalizowaną enzymatyczną acylację grup aminowych lub hydroksylowych za pomocą kwasów tłuszczowych. Najwcześniejszy raport na temat bezzwrotnej syntezy katalizowanej lipazą aminokwasowych pochodnych amidowych lub metylowych wykorzystywał Candida Antarkctica, z wydajnościami w zakresie od 25% do 90% w zależności od docelowego aminokwasu. W niektórych reakcjach w niektórych reakcjach zastosowano również keton metylu etylu jako rozpuszczalnik. Vonderhagen i in. Opisał także reakcje lipazy i katalizowanych proteazą N-acylacji aminokwasów, hydrolizatów białek i/lub ich pochodnych przy użyciu mieszaniny wody i rozpuszczalników organicznych (np. Dimetyloformamidu/wody) i ketonu butylu metylowego.
Na początku głównym problemem z katalizowaną enzymem syntezą AA były niskie wydajność. Według Valivety i in. Wydajność pochodnych aminokwasów N-tetradekanoilowych wynosiła tylko 2% -10% nawet po użyciu różnych lipaz i inkubacji w 70 ° C przez wiele dni. Montet i in. napotkały również problemy dotyczące niskiej wydajności aminokwasów w syntezie lizyny n-acylowej przy użyciu kwasów tłuszczowych i olejków roślinnych. Według nich maksymalna wydajność produktu wynosiła 19% w warunkach wolnych od rozpuszczalników i stosowanie rozpuszczalników organicznych. Ten sam problem napotkał Valivety i in. W syntezie pochodnych estrów metylowych N-CBZ-L lub N-CBZ-lizyny.
W tym badaniu twierdzili, że wydajność 3-O-tetradekanoilo-L-seryna wynosiła 80% przy użyciu seryny chronionej N jako substratu i novozyme 435 jako katalizatora w środowisku pozbawionym rozpuszczalników. Nagao i Kito badali O-acylację L-Serinę, L-homoserynę, L-treoninę i L-tyrozynę (LET) przy użyciu lipazy wyniki reakcji (lipaza uzyskano przez Candida cylindracea i rhizopus delemar w aquious buffer) Acylacja L-teoniny i Let Wystąpiła.
Wielu badaczy poparło stosowanie niedrogich i łatwo dostępnych substratów do syntezy opłacalnych AA. Soo i in. twierdził, że przygotowanie środków powierzchniowo czynnych na bazie oleju palmowego najlepiej działa z unieruchomionym lipoenzymem. Zauważyli, że wydajność produktów byłaby lepsza pomimo czasochłonnej reakcji (6 dni). Gerova i in. zbadał syntezę i aktywność powierzchniową chiralnego N-palmitoilowego AA w oparciu o metioninę, prolinę, leucynę, treoninę, fenyloalaninę i fenyloglicynę w mieszaninie cyklicznej/racemicznej. Pang i Chu opisali synteza monomerów na bazie aminokwasów i monomerów na bazie kwasu dikarboksylowego w roztworze Seria funkcjonalnych i biodegradowalnych estrów poliamidowych na bazie aminokwasów zsyntetyzowano przez reakcje korektacji w roztworze.
Cantaeuzene i Guerreiro zgłosili esteryfikację grup kwasu karboksylowego BOC-ALA-OH i BOC-ASP-OH z długim łańcuchem alifatycznym alkohol i diols, z dichlorometanem jako rozpuszczalnikiem i agarozą 4B (sifarozę 4b) jako katalizator. W tym badaniu reakcja BOC-ALA-OH z tłuszczowymi alkoholem do 16 węgli dała dobre plony (51%), podczas gdy w przypadku BOC-ASP-OH 6 i 12 węgli była lepsza, z odpowiednią wydajnością 63% [64]. 99,9%) w wydajnościach od 58%do 76%, które zostały zsyntetyzowane przez tworzenie wiązań amidowych z różnymi długim łańcuchem alkiloamin lub wiązań estrowych z alkoholem tłuszczu przez CBZ-Arg-Ome, gdzie papaina działała jako katalizator.
5.2.2 Synteza surfaktantów aminokwasowych/peptydowych na bazie Gemini
Surfaktanty gemini na bazie aminokwasów składają się z dwóch prostych cząsteczek AAS połączonych ze sobą przez grupę dystansów. Istnieją 2 możliwe schematy chemoenzymatycznej syntezy środków powierzchniowo czynnych na bazie aminokwasów typu gemini (ryc. 6 i 7). Na rycinie 6, 2 pochodne aminokwasowe są reagowane na związek jako grupa przeciągania, a następnie wprowadzono 2 grupy hydrofobowe. Na ryc. 7 2 struktury prostych łańcuchów są bezpośrednio połączone przez dwufunkcyjną grupę dystansów.
Najwcześniejszy rozwój katalizowanej enzymatyczną syntezą lipoaminokwasów Gemini był pionierem przez Valivety i in. Yoshimura i in. zbadał syntezę, adsorpcję i agregację środka powierzchniowo czynnego na bazie aminokwasów na bazie gemini na podstawie cystyny i bromku N-alkilowego. Zsyntetyzowane środki powierzchniowo czynne porównano z odpowiednimi monomerycznymi środkami powierzchniowo czynnymi. Faustino i in. Opisał syntezę anionowych monomerycznych AA opartych na AA opartych na L-Cystine, D-Cystine, DL-Cystine, L-Cysteine, L-metioninie i L-sulfoalaninie oraz ich parach gemini za pomocą przewodności, napięcia powierzchniowego równowagi i stałego stanu fluorescencyjnego. Wykazano, że wartość CMC gemini była niższa poprzez porównanie monomeru i gemini.
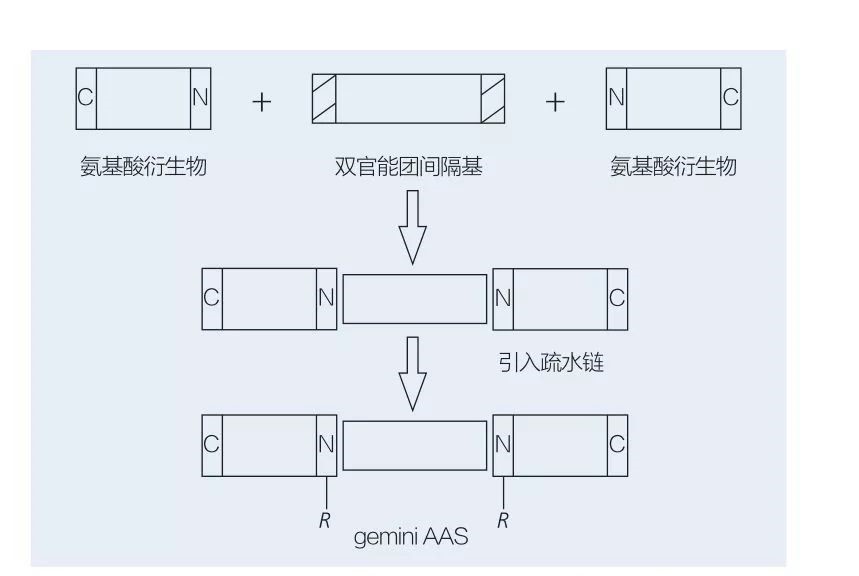
Ryc. 6 Synteza AA Gemini przy użyciu pochodnych AA i dystansu, a następnie wprowadzenie grupy hydrofobowej
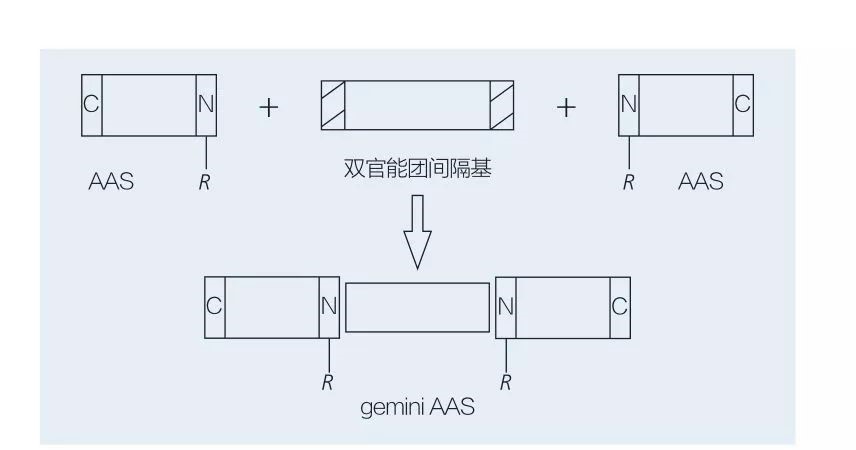
Ryc. 7 Synteza ASAS GEMINI przy użyciu dwufunkcyjnego dystansu i AAS
5.2.3 Synteza glicerolipidowych aminokwasowych/peptydowych środków powierzchniowo czynnych
Glicerolipidowe aminokwas/peptyd środki powierzchniowo czynne są nową klasą aminokwasów lipidowych, które są strukturalnymi analogami estrów mono- (lub di- lub fosfolipidów, ze względu na ich strukturę jednego lub dwóch tłuszczowych łańcuchów z jednym aminokwasem połączonym z backbonerem glicerolu przez wiązanie estrowe. Synteza tych środków powierzchniowo czynnych zaczyna się od przygotowania estrów glicerolu aminokwasów w podwyższonych temperaturach i w obecności kwaśnego katalizatora (np. BF 3). Dobrym opcją jest również synteza katalizowana enzymem (przy użyciu hydrolaz, proteazy i lipazy jako katalizatorów) (ryc. 8).
Zgłoszono katalizowaną enzymatyczną syntezą koniugatów glicerydów argininowych za pomocą papainy. Zgłoszono również syntezę koniugatów estru diacyloglicerolu z acetylargininy i ocena ich właściwości fizykochemicznych.
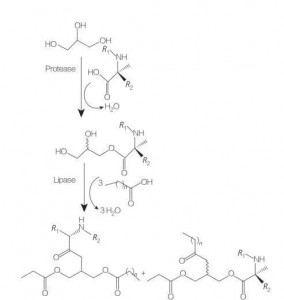
Ryc. 8 Synteza koniugatów aminokwasów mono i diacyloglicerolu
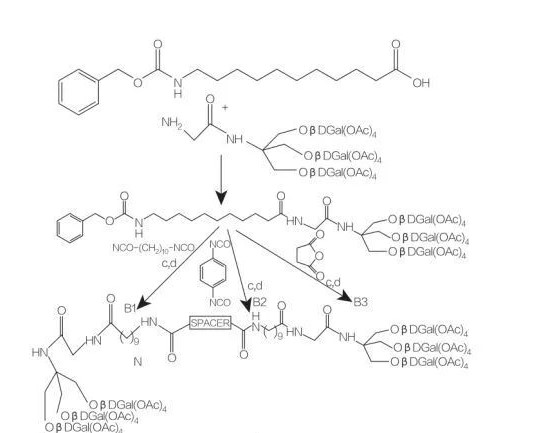
Spacer: NH- (rozdz2)10-NH: Compedb1
Spacer: NH-C6H4-NH: Compedb2
Spacer: Ch2-Ch2: Componeb3
Ryc. 9 Synteza symetrycznych amfifili pochodzących z Tris (hydroksymetylo) aminometan
5.2.4 Synteza surfaktantów aminokwasowych/peptydowych na bazie bolu
Aminokwasowe amfifily typu bola zawierają 2 aminokwasy, które są połączone z tym samym łańcuchem hydrofobowym. Franceschi i in. Opisał syntezę amfifili typu Bola z 2 aminokwasami (D- lub L-alanine lub L-histidine) i 1 łańcuch alkilowy o różnych długościach i badał ich aktywność powierzchniową. Omawiają syntezę i agregację nowych amfifili typu Bola z frakcją aminokwasową (przy użyciu niezwykłego β-aminokwasu lub alkoholu) oraz grupy przekładającej C12 -C20. Zastosowane β-aminokwasy β-aminokwasy mogą być aminokwasem cukrowym, aminokwasem pochodzącym z azidotyminy (AZT), aminokwasem norborodowym i alkoholem aminowego pochodzącego z AZT (ryc. 9). Synteza symetrycznych amfifili typu Bola pochodzących z Tris (hydroksymetylo) aminometanu (Tris) (ryc. 9).
06 Właściwości fizykochemiczne
Powszechnie wiadomo, że środki powierzchniowo czynne (AA) mają zróżnicowane i wszechstronne natury i mają dobre zastosowanie w wielu zastosowaniach, takich jak dobra solubilizacja, dobre właściwości emulgowania, wysoka wydajność, wysoka działanie powierzchniowe i dobra odporność na wodę twardą (tolerancja jonów wapnia).
W oparciu o właściwości środków powierzchniowo czynnych aminokwasów (np. Napięcie powierzchniowe, CMC, zachowanie fazowe i temperatura KRAFFT), po szeroko zakrojonych badaniach osiągnięto następujące wnioski - aktywność powierzchniowa AA jest lepsza od jego konwencjonalnego odpowiednika środka powierzchniowo czynnego.
6.1 Krytyczne stężenie miceli (CMC)
Krytyczne stężenie miceli jest jednym z ważnych parametrów środków powierzchniowo czynnych i reguluje wiele właściwości aktywnych powierzchniowych, takich jak rozpuszczenie, liza komórek i jej interakcja z biofilmami itp. Zasadniczo zwiększając długość łańcucha ogona węglowodorowego (rosnąca hydrofobowość) prowadzi do zmniejszenia CMC roztworu surfaktanta, w ten sposób zwiększając jego aktywność powierzchniową. Środki powierzchniowo czynne oparte na aminokwasach zwykle mają niższe wartości CMC w porównaniu z konwencjonalnymi środkami powierzchniowo czynnymi.
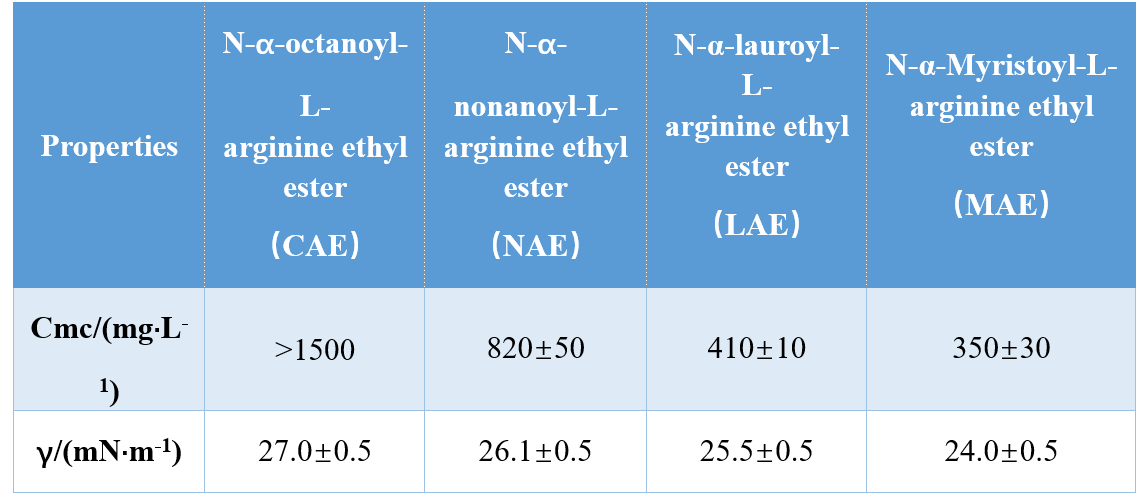
Dzięki różnym kombinacjom grup głowy i hydrofobowych ogonów (amid mono-katacyjny, biationowy amid, biationowy ester na bazie amidu), Infante i in. Zsyntetyzowało trzy AA na bazie argininy i badali ich CMC i γCMC (napięcie powierzchniowe w CMC), pokazując, że wartości CMC i γCMC zmniejszają się wraz ze wzrostem hydrofobowej długości ogona. W innym badaniu Singre i Mhatre stwierdzili, że CMC surfaktantów N-α-acylargininy zmniejszyło się wraz ze wzrostem liczby hydrofobowych atomów węgla ogona (Tabela 1).
Yoshimura i in. zbadał CMC pochodzących z cysteiny aminokwasowych środków powierzchniowo czynnych na bazie aminokwasów i wykazał, że CMC zmniejszyła się, gdy długość łańcucha węgla w łańcuchu hydrofobowym wzrosła z 10 do 12. dalsze zwiększenie długości łańcucha węgla do 14 spowodowało wzrost CMC, co potwierdziło, że długie łańcuchowe geminiczne gemini mają tętno.
Faustino i in. poinformował o tworzeniu mieszanych miceli w wodnych roztworach środków powierzchniowo czynnych anionowych gemini na podstawie cystyny. Środki powierzchniowo czynne Gemini porównano również z odpowiednimi konwencjonalnymi monomerycznymi środkami powierzchniowo czynnymi (C 8 Cys). Wartości CMC mieszanin lipidowo-czynników były zgłaszane jako niższe niż w przypadku czystych środków powierzchniowo czynnych. Gemini surfaktanty i 1,2-diheptanoilo-SN-glicerylo-3-fosfocholina, rozpuszczalny w wodzie fosfolipid tworzący micele, miały CMC na poziomie milimolarnym.
Shrestha i Aramaki zbadali tworzenie lepkosprężystych miceli podobnych do robaka w wodnych roztworach mieszanych środków powierzchniowo czynnych na bazie mieszanych aminokwasów przy braku soli domieszki. W tym badaniu stwierdzono, że N-Dodecylu Glutaminian ma wyższą temperaturę Kraffta; Jednak po neutralizowaniu podstawowym aminokwasowym L-lizyną generował micele, a roztwór zaczął zachowywać się jak płyn newtonowski w temperaturze 25 ° C.
6.2 Dobra rozpuszczalność w wodzie
Dobra rozpuszczalność w wodzie AA wynika z obecności dodatkowych wiązań CO-NH. To sprawia, że AA są bardziej biodegradowalne i przyjazne dla środowiska niż odpowiednie konwencjonalne środki powierzchniowo czynne. Rozpuszczalność w wodzie kwasu N-acyl-L-glutaminowego jest jeszcze lepsza ze względu na 2 grupy karboksylowe. Rozpuszczalność w wodzie CN (CA) 2 jest również dobra, ponieważ w 1 jonowych grup argininy w 1 cząsteczce, co powoduje bardziej skuteczną adsorpcję i dyfuzję na interfejsie komórkowym, a nawet skuteczne hamowanie bakteryjne w niższych stężeniach.
6.3 Temperatura KRAFFT i punkt KRAFFT
Temperaturę KRAFFT można rozumieć jako specyficzne zachowanie rozpuszczalności środków powierzchniowo czynnych, których rozpuszczalność wzrasta gwałtownie powyżej określonej temperatury. Jonowe środki powierzchniowo czynne mają tendencję do generowania hydratów stałych, które mogą wytrącić z wody. W określonej temperaturze (tak zwana temperatura KRAFFT) zwykle obserwuje się dramatyczny i nieciągły wzrost rozpuszczalności środków powierzchniowo czynnych. Punktem Kraffta jonowego środka powierzchniowo czynnego jest jego temperatura Kraffta w CMC.
Ta charakterystyka rozpuszczalności jest zwykle widoczna dla jonowych środków powierzchniowo czynnych i można ją wyjaśnić w następujący sposób: rozpuszczalność monomeru wolnego od środka powierzchniowo czynnego jest ograniczona poniżej temperatury Kraffta do momentu osiągnięcia punktu Kraffta, gdzie jego rozpuszczalność stopniowo wzrasta z powodu tworzenia miceli. Aby zapewnić całkowitą rozpuszczalność, konieczne jest przygotowanie preparatów powierzchniowo czynnych w temperaturach powyżej punktu Krafft.
Temperatura Kraffta AA została zbadana i porównana z temperaturą konwencjonalnych syntetycznych środków powierzchniowo czynnych. Shrestha i Aramaki badali temperaturę KRAFFT na bazie argininy AA i stwierdzono, że krytyczne stężenie miceli wykazywało zachowania agregacyjne w postaci przed mikrofonami powyżej 2-5 × 10-6 mol-l -1, a następnie formację miceli (OHTA i in. Syntesowanie sześciu różnych rodzajów rodzajów różnorodnych rodzajów litości różnych rodzajów litości sześcioosobowych pozycji Mol. N-hexadecanoil AA i omówił związek między ich temperaturą Krafft a resztami aminokwasowymi.
W eksperymentach stwierdzono, że temperatura Kraffta N-heksadekanoilowego AA wzrosła wraz ze spadkiem reszt aminokwasowych (fenyloalanina jest wyjątkiem), podczas gdy ciepło rozpuszczalności (pobieranie ciepła) wzrosło wraz ze spadkiem wielkości reszt aminokwasowych (z wyjątkiem glicyny i fenyloalaniny). Stwierdzono, że zarówno w układach alaniny, jak i fenyloalaninie interakcja DL jest silniejsza niż interakcja LL w postaci stałej soli N-heksadekanoilowej AAS.
Brito i in. Określono temperaturę KRAFFT trzech serii nowych środków powierzchniowo czynnych aminokwasowych przy użyciu różnicowej mikrokalorymetrii skanowania i stwierdził, że zmiana jonu trifluorooctanowego na jon jodku spowodował znaczny wzrost temperatury Krafft (około 6 ° C), od 47 ° C na 53 ° C. Obecność wiązań podwójnych cis i nienasycenie występujące w długotrwałym ser-pochodnym doprowadziły do znacznego spadku temperatury Kraffta. Doniesiono, że glutaminian N-dodecylu ma wyższą temperaturę KRAFFT. Jednak neutralizacja podstawową aminokwasową L-lizyną spowodowała powstawanie miceli w roztworze, które zachowały się jak płyny newtonowskie w temperaturze 25 ° C.
6.4 Napięcie powierzchniowe
Napięcie powierzchniowe środków powierzchniowo czynnych jest związane z długością łańcucha części hydrofobowej. Zhang i in. określono napięcie powierzchniowe glicynu kokoilowego sodu za pomocą metody płyty Wilhelmy (25 ± 0,2) ° C i określono wartość napięcia powierzchniowego w CMC jako 33 mn -m -1, CMC jako 0,21 mmol -L -1. Yoshimura i in. określono napięcie powierzchniowe 2c N Cys typu aminokwasowego napięcia powierzchniowe powierzchniowe 2C N CYS Active Active Active. Stwierdzono, że napięcie powierzchniowe w CMC zmniejszało się wraz ze wzrostem długości łańcucha (do n = 8), podczas gdy trend został odwrócony dla środków powierzchniowo czynnych o n = 12 lub dłuższych długości łańcucha.
Badano również wpływ CAC1 2 na napięcie powierzchniowe dikarboksylowanych środków powierzchniowo czynnych na bazie aminokwasów. W tych badaniach CAC1 2 dodano do roztworów wodnych trzech dikarboksylowanych środków powierzchniowo czynnych typu aminokwasowego (C12 Malna 2, C12 AspNA 2 i C12 Gluna 2). Porównano wartości płaskowyżu po CMC i stwierdzono, że napięcie powierzchniowe zmniejszało się przy bardzo niskich stężeniach CAC1 2. Wynika to z wpływu jonów wapnia na rozmieszczenie środka powierzchniowo czynnego na interfejsie wody gazowej. Z drugiej strony napięcia powierzchniowe soli N-dodecyloaminomalonianu i N-dodecylasparaparparaganu były również prawie stałe do 10 mmol-L-1 CAC1 2. Powyżej 10 mmol -L - W przypadku soli disodowej glutaminianu N-dodecylu umiarkowane dodanie CAC1 2 spowodowało znaczny spadek napięcia powierzchniowego, podczas gdy ciągły wzrost stężenia CAC1 2 nie spowodował już znaczących zmian.
Aby określić kinetykę adsorpcji AA typu Gemini-Type na interfejsie wody gazowej, dynamiczne napięcie powierzchniowe określono za pomocą maksymalnej metody ciśnienia pęcherzykowego. Wyniki wykazały, że przez najdłuższy czas testu dynamiczne napięcie powierzchniowe 2C 12 Cys nie zmieniło się. Zmniejszenie dynamicznego napięcia powierzchniowego zależy tylko od stężenia, długości hydrofobowych ogonów i liczby hydrofobowych ogonów. Rosnące stężenie środka powierzchniowo czynnego, zmniejszenie długości łańcucha, a także liczba łańcuchów spowodowało szybszy rozkład. Wyniki uzyskane dla wyższych stężeń C N Cys (N = 8 do 12) okazały się bardzo blisko γ CMC mierzone metodą Wilhelmy.
W innym badaniu dynamiczne napięcia powierzchniowe sodu dyrylowa (SDLC) i sodu didecamino cystyna określono metodą płyty Wilhelmy, a ponadto określono napięcia powierzchniowe ich roztworów wodnych. Reakcję wiązań disiarczkowych została również dalej badana innymi metodami. Dodanie merkaptoetanolu do roztworu 0,1 mmol -L -1SDLC doprowadziło do szybkiego wzrostu napięcia powierzchniowego z 34 mn -m -1 do 53 mn -m -1. Ponieważ NaCLO może utleniać wiązania disiarczkowe SDLC do grup kwasu sulfonowego, nie zaobserwowano agregatów, gdy NaClo (5 mmol -L -1) dodano do roztworu SDLC 0,1 mmol -L -1. Transmisyjna mikroskopia elektronowa i dynamiczne wyniki rozpraszania światła wykazały, że w roztworze nie powstały żadne agregaty. Stwierdzono, że napięcie powierzchniowe SDLC wzrasta z 34 mn -m -1 do 60 mn -m -1 w ciągu 20 minut.
6.5 Binarne interakcje powierzchniowe
W naukach życiowych wiele grup badało właściwości wibracyjne mieszanin kationowych AA (surfaktanty na bazie argininy diatyloglicerolu) i fosfolipidów na interfejsie gazowej, co ostatecznie stwierdzając, że ta właściwości nie idealna powoduje występowanie interakcji elektrostatycznych.
6.6 Właściwości agregacji
Dynamiczne rozpraszanie światła jest powszechnie stosowane do określenia właściwości agregacji monomerów na bazie aminokwasów i środków powierzchniowo czynnych Gemini w stężeniach powyżej CMC, co daje pozorną średnicę hydrodynamiczną DH (= 2R h). Agregaty utworzone przez C N CYS i 2CN Cys są stosunkowo duże i mają rozkład szerokiej skali w porównaniu z innymi środkami powierzchniowo czynnymi. Wszystkie środki powierzchniowo czynne z wyjątkiem 2C 12 Cys zwykle tworzą agregaty około 10 nm. Rozmiary miceli środków powierzchniowo czynnych Gemini są znacznie większe niż rozmiary ich monomerycznych odpowiedników. Wzrost długości łańcucha węglowodorów prowadzi również do wzrostu wielkości miceli. Ohta i in. Opisał właściwości agregacji trzech różnych stereoizomerów n-dodecylo-fenylo-alanylo-fenylo-alaniny tetrametyloamonium w roztworze wodnym i wykazały, że diastereoizomery mają to samo krytyczne stężenie agregacji w roztworze wodnym. Iwahashi i in. badane przez okrągły dichroizm, Osmometria NMR i pary ciśnienia Pory Utworzenie chiralnych agregatów N-Dodekanoilo-L-glutamintrile, 1,4-diokanoil-l-waliina i ich estry metylowe w różnych roztworach (takie jak tetrahydrofuran, acetonitryl, 1,4-dioksan i 1,2-dichloroetan) z rotakiem. przez okrągły dichroizm, NMR i osmometria ciśnienia pary.
6.7 Adsorpcja międzyfazowa
Międzyfazowa adsorpcja środków powierzchniowo czynnych na bazie aminokwasów i jego porównanie z jego konwencjonalnym odpowiednikiem jest również jednym z kierunków badań. Na przykład zbadano właściwości adsorpcji międzyfazowej estrów dodecylowych aromatycznych aminokwasów uzyskanych z LET i LEP. Wyniki pokazały, że LET i LEP wykazywały niższe obszary międzyfazowe na interfejsie gazowym i ciecz i na interfejsie wody/heksanu.
Bordes i in. Zbadał zachowanie roztworu i adsorpcję na interfejsie gazu-wodzie trzech dikarboksylowanych środków powierzchniowo czynnych aminokwasowych, soli disodum glutaminianu dodecylu, asparaginianu dodecylu i aminomalonianu (odpowiednio z 3, 2 i 1 atomami węgla między dwoma grupami karboksylowymi). Według tego raportu CMC dikarboksylowanych środków powierzchniowo czynnych było 4-5 razy wyższe niż w przypadku monokarboksylowanej soli dodecylowej glicyny. Jest to przypisywane tworzeniu wiązań wodorowych między dikarboksylowanymi środkami powierzchniowo czynnymi a sąsiednimi cząsteczkami przez grupy amidowe.
6.8 Zachowanie fazowe
Izotropowe nieciągłe fazy sześcienne obserwuje się w przypadku środków powierzchniowo czynnych w bardzo wysokich stężeniach. Cząsteczki środków powierzchniowo czynnych z bardzo dużymi grupami głowy mają tendencję do tworzenia agregatów mniejszej dodatniej krzywizny. Marques i in. Zbadał zachowanie fazowe systemów 12Lys12/12ser i 8Lys8/16Ser (patrz ryc. 10), a wyniki wykazały, że system 12Lys12/12Ser ma strefę separacji fazowej między regionami fazy micelarnej i pęcherzykowej między regionami fazy miceli, między regionem fazy miceli, między regionem fazy miceli, a regionem fazy 8Lys8/16ser i regionem i 16Ser. region fazowy pęcherzyków). Należy zauważyć, że w przypadku obszaru pęcherzyków układu 12Lys12/12ser pęcherzyki zawsze współistnieją z miceli, podczas gdy region pęcherzyków układu 8LYS8/16SER ma tylko pęcherzyki.
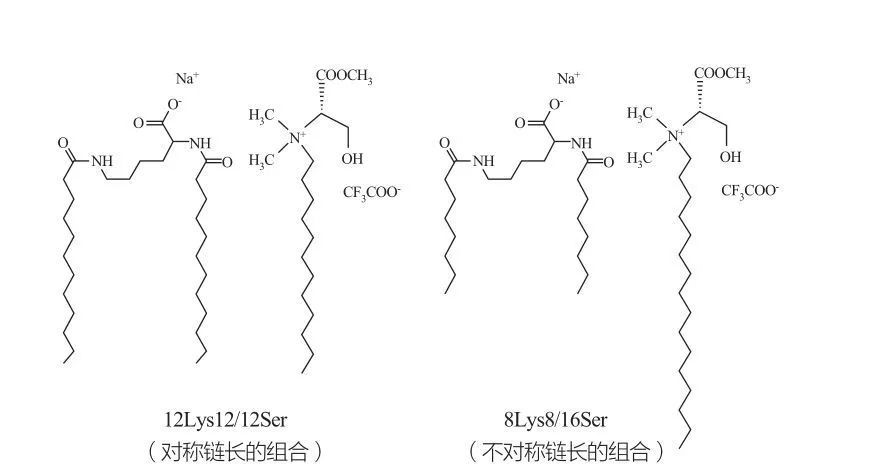
Katanionowe mieszaniny środków powierzchniowo czynnych na bazie lizyny i seryny: symetryczna para 12LYS12/12SER (po lewej) i asymetryczna para 8LYS8/16SER (po prawej)
6.9 Zdolność emulgowania
Kouchi i in. zbadał zdolność emulgującą, napięcie międzyfazowe, dyspergowalność i lepkość n- [3-dodecylo-2-hydroksypropylo]-l-arginina, l-glutaminian i inne AA. W porównaniu z syntetycznymi środkami powierzchniowo czynnymi (ich konwencjonalne niejonowe i amfoteryczne odpowiedniki) wyniki wykazały, że AA mają silniejszą zdolność emulgującą niż konwencjonalne środki powierzchniowo czynne.
Baczko i in. Zsyntetyzowane nowe środki powierzchniowo czynne anionowe i badały ich przydatność jako chiralne rozpuszczalniki spektroskopowe NMR. Serię amfifilowych pochodnych L-PHE lub L-ALA z różnymi hydrofobowymi ogonami (pentyl ~ tetradecyl) zsyntetyzowano przez reakcję aminokwasów z bezwodem o-sulfobenzoicznym. Wu i in. zsyntetyzowane sole sodu AAS izbadali ich zdolność emulgowania w emulsjach olejowych w wodzie, a wyniki wykazały, że te środki powierzchniowo czynne działały lepiej z octanem etylu jako fazą olejową niż z n-heksanu jako fazy olejowej.
6.10 Postępy w syntezie i produkcji
Hard Oporność na wodę można rozumieć jako zdolność środków powierzchniowo czynnych do odporności na obecność jonów, takich jak wapń i magnez w twardej wodzie, tj. Zdolność do unikania wytrącania się w mydłach wapnia. Surfaktanty o wysokiej twardej oporności na wodę są bardzo przydatne w przypadku preparatów detergentów i produktów higieny osobistej. Odporność na wodę twardą można ocenić, obliczając zmianę rozpuszczalności i aktywności powierzchniowej powierzchni powierzchniowo czynnego w obecności jonów wapnia.
Innym sposobem oceny twardej odporności na wodę jest obliczenie procentu lub gramów środka powierzchniowo czynnego wymaganego dla mydła wapnia utworzonego ze 100 g oleinianu sodu, aby zostać rozproszonym w wodzie. Na obszarach o wysokiej twardej wody wysokie stężenia jonów wapnia i magnezu oraz zawartości minerałów mogą utrudniać praktyczne zastosowania. Często jon sodu jest stosowany jako kontr -jon syntetycznego anionowego środka powierzchniowo czynnego. Ponieważ zbieżne jon wapnia jest związany z obiema cząsteczkami środków powierzchniowo czynnych, powoduje, że surfaktant łatwiej wytrąca się z roztworem, co powoduje, że detergencja jest mniej prawdopodobna.
Badanie oporności na twardą wodę AA wykazało, że na oporność na kwas i twardą wodę miała silny wpływ dodatkowej grupy karboksylowej, a oporność na kwas i twardą wodę wzrosły wraz ze wzrostem długości grupy przekładki między dwiema grupami karboksylowymi. Kolejność oporności na kwas i twardą wodoodporność wynosił C 12 glicynian <C 12 asparaginian <C 12 glutaminian. Porównując odpowiednio dikarboksylowane wiązanie amidowe i dikarboksylowany surfaktant aminowy, stwierdzono, że zakres pH tego ostatniego był szerszy, a jego aktywność powierzchniowa wzrosła wraz z dodaniem odpowiedniej ilości kwasu. Dikarboksylowane aminokwasy N-alkilowe wykazały działanie chelatujące w obecności jonów wapnia, a biały żel utworzony C 12. C 12 glutaminian wykazywał wysoką aktywność powierzchni przy wysokim stężeniu Ca2+ i oczekuje się, że zostanie zastosowany w odsalaniu wody morskiej.
6.11 dyspergowalność
Rozproszenie odnosi się do zdolności środka powierzchniowo czynnego do zapobiegania koalescencji i sedymentacji środka powierzchniowo czynnego w roztworze.Dyspergowalność jest ważną właściwością środków powierzchniowo czynnych, która sprawia, że są odpowiednie do stosowania w detergentach, kosmetykach i farmaceutykach.Środek dyspergujący musi zawierać wiązanie estra, eteru, amidu lub aminowego między grupą hydrofobową a końcową grupą hydrofilową (lub wśród grup hydrofobowych łańcucha prostego).
Zasadniczo anionowe środki powierzchniowo czynne, takie jak siarczany alkanolamido i amfoteryczne środki powierzchniowo czynne, takie jak amidosulfobetainy, są szczególnie skuteczne jako środki rozpraszające mydła wapnia.
Wiele wysiłków badawczych określiło dyspergowalność AA, w której stwierdzono, że lizyna N-Lauroyl jest słabo kompatybilna z wodą i trudna w użyciu do preparatów kosmetycznych.W tej serii podstawowe aminokwasy podstawione N-Acyl mają doskonałą dyspergowalność i są stosowane w przemyśle kosmetycznym w celu poprawy preparatów.
07 Toksyczność
Konwencjonalne środki powierzchniowo czynne, zwłaszcza kationowe środki powierzchniowo czynne, są wysoce toksyczne dla organizmów wodnych. Ich ostra toksyczność wynika z zjawiska interakcji środków powierzchniowo czynnych adsorpcji na interfejsie wody komórkowej. Zmniejszenie CMC środków powierzchniowo czynnych zwykle prowadzi do silniejszej adsorpcji środków powierzchniowo czynnych, co zwykle powoduje ich podwyższoną ostrą toksyczność. Wzrost długości hydrofobowego łańcucha środków powierzchniowo czynnych prowadzi również do wzrostu ostrej toksyczności surfaktantów.Większość AA jest niska lub nietoksyczna dla ludzi i środowiska (szczególnie dla organizmów morskich) i nadaje się do stosowania jako składniki żywności, farmaceutyki i kosmetyki.Wielu badaczy wykazało, że środki powierzchniowo czynne aminokwasowe są delikatne i niewidoczne dla skóry. Wiadomo, że surfaktanty na bazie argininy są mniej toksyczne niż ich konwencjonalne odpowiedniki.
Brito i in. Badał właściwości fizykochemiczne i toksykologiczne amfifili na bazie aminokwasów i ich [pochodne z tyrozyny (TYR), hydroksyproliny (HYP), seryny (Ser) i lizyny (Lys)] spontaniczne tworzenie pęcherzyków kationowych i przekazało dane dotyczące ich toksyczności ostrej Dapnia Magna (IC 50). Syntetyzowali kationowe pęcherzyki bromku dodecyltrimetyloamoniowego (DTAB)/Lys-deryvativatity i/lub ser-/Lys-derbsyjne mieszanki i badali ich ekotoksyczność i potencjał hemolityczny, co pokazuje, że wszystkie AA i ich mieszanki zawierające pęcherzyki były mniej toksyczne niż konwencjonalne DTAB surowca surowca.
Rosa i in. zbadał wiązanie (powiązanie) DNA do stabilnych pęcherzyków kationowych na bazie aminokwasów. W przeciwieństwie do konwencjonalnych kationowych środków powierzchniowo czynnych, które często wydają się toksyczne, interakcja kationowych aminokwasowych środków powierzchniowo czynnych wydaje się nietoksyczna. Kationowe AA oparte jest na argininie, która spontanicznie tworzy stabilne pęcherzyki w połączeniu z niektórymi anionowymi środkami powierzchniowo czynnymi. Doniesiono również, że inhibitory korozji na bazie aminokwasów są również nietoksyczne. Te środki powierzchniowo czynne są łatwo zsyntetyzowane z wysoką czystością (do 99%), niskim kosztem, łatwo biodegradowalnym i całkowicie rozpuszczalnym w pożywkach wodnych. Kilka badań wykazało, że środki powierzchniowo czynne zawierające siarkę są lepsze w hamowaniu korozji.
W ostatnim badaniu Perinelli i in. zgłosił zadowalający profil toksykologiczny rhamnolipidów w porównaniu z konwencjonalnymi środkami powierzchniowo czynnymi. Wiadomo, że rhamnolipidy działają jako wzmacniacze przepuszczalności. Zgłosili także wpływ ramnolipidów na przepuszczalność nabłonka leków makrocząsteczkowych.
08 Aktywność przeciwdrobnoustrojowa
Aktywność przeciwdrobnoustrojową środków powierzchniowo czynnych można ocenić na podstawie minimalnego stężenia hamowania. Aktywność przeciwdrobnoustrojową środków powierzchniowo czynnych na bazie argininy została szczegółowo zbadana. Stwierdzono, że bakterie Gram-ujemne są bardziej odporne na środki powierzchniowo czynne na bazie argininy niż bakterie Gram-dodatnie. Aktywność przeciwdrobnoustrojowa środków powierzchniowo czynnych jest zwykle zwiększana przez obecność wiązań hydroksylowych, cyklopropanu lub nienasyconych w łańcuchach acylowych. Castillo i in. wykazał, że długość łańcuchów acylowych i ładunek dodatni określa wartość HLB (równowaga hydrofilowa lipofilowa) cząsteczki, a one mają one wpływ na ich zdolność do zakłócenia błon. Ester metylowy Nα-acylargininy jest kolejną ważną klasą kationowych środków powierzchniowo czynnych z aktywnością przeciwdrobnoustrojową o szerokim spektrum. I jest łatwo biodegradowalna i ma niską toksyczność lub bez toksyczności. Badania interakcji środków powierzchniowo czynnych na bazie estru metylo-estru metylo-estrowego Nα-acylargininy z 1,2-dipalmitoilo-sn-propyltrioksylo-3-fosforylocholiny i 1,2-diTetradekanoilo-SN-propyltrioksylo-3-fosforylocholiny, modelowych membranowych membranowych i organizatorów żywych organizmów w obecności lub braku zewnętrznej bariery środków powierzchniowo-fosforylocholiny, modelu Wyniki przeciwdrobnoustrojowe wykazały, że środki powierzchniowo czynne mają dobrą aktywność przeciwbakteryjną.
09 Właściwości reologiczne
Właściwości reologiczne środków powierzchniowo czynnych odgrywają bardzo ważną rolę w określaniu i przewidywaniu ich zastosowań w różnych branżach, w tym w produktach produktów farmaceutycznych, wydobycia ropy, higieny osobistej i opieki domowej. Przeprowadzono wiele badań w celu omówienia związku między lepkosprężystością środków powierzchniowo czynnych aminokwasowych a CMC.
10 zastosowań w branży kosmetycznej
AA są używane w sformułowaniu wielu produktów do higieny osobistej.Glicynian n-kokoilu potasu jest delikatny na skórze i jest stosowany w oczyszczaniu twarzy w celu usunięcia szlamu i makijażu. Kwas n-acyl-l-glutamin ma dwie grupy karboksylowe, co czyni go bardziej rozpuszczalnym w wodzie. Wśród tych AA AA oparte na C 12 kwasów tłuszczowych są szeroko stosowane w oczyszczaniu twarzy w celu usunięcia szlamu i makijażu. AA z łańcuchem C 18 są stosowane jako emulgatory w produktach do pielęgnacji skóry, a sole n-lauryl alanine tworzą kremowe piany, które nie są drażniące dla skóry i dlatego mogą być stosowane w preparatie produktów opieki nad niemowlętą. AA na bazie N-laurylowych stosowane w pasty do zębów mają dobry detergencja podobna do mydła i silna skuteczność hamująca enzym.
W ciągu ostatnich kilku dziesięcioleci wybór środków powierzchniowo czynnych dla kosmetyków, produktów do higieny osobistej i farmaceutyków koncentrował się na niskiej toksyczności, łagodności, łagodności w dotyku i bezpieczeństwie. Konsumenci tych produktów doskonale zdają sobie sprawę z potencjalnej podrażnienia, toksyczności i czynników środowiskowych.
Dzisiaj AA są używane do sformułowania wielu szamponów, barwników do włosów i mydeł do kąpieli ze względu na ich wiele zalet nad tradycyjnymi odpowiednikami w kosmetykach i produktach do higieny osobistej.Środki powierzchniowo czynne na bazie białka mają pożądane właściwości niezbędne do produktów do higieny osobistej. Niektóre AA mają możliwości tworzenia filmów, podczas gdy inne mają dobre możliwości spożywcze.
Aminokwasy są ważne naturalnie występujące czynniki nawilżające w warstwie rogowej. Kiedy komórki naskórka umierają, stają się częścią warstwy rogowej, a białka wewnątrzkomórkowe są stopniowo degradowane do aminokwasów. Te aminokwasy są następnie transportowane dalej do warstwy rogowej, gdzie wchłaniają substancje tłuszczowe lub tłuszczowe do naskórka warstwy rogowej, poprawiając w ten sposób elastyczność powierzchni skóry. Około 50% naturalnego czynnika nawilżającego w skórze składa się z aminokwasów i pirolidonu.
Kolagen, wspólny składnik kosmetyczny, zawiera również aminokwasy, które utrzymują miękką skórę.Problemy skórne, takie jak chropowatość i tulność, w dużej mierze wynikają z braku aminokwasów. Jedno badanie wykazało, że mieszanie aminokwasu z odpalami skóry zwolnionym z maści, a dotknięte obszary powróciły do ich normalnego stanu, nie stając się bliznami keloidowymi.
Stwierdzono również, że aminokwasy są bardzo przydatne w opiece nad uszkodzonymi skórkami.Suche, bezkształtne włosy mogą wskazywać na zmniejszenie stężenia aminokwasów w poważnie uszkodzonym warstwie rogowniczym. Aminokwasy mają zdolność wnikania skóry do wału do włosów i pochłaniania wilgoci ze skóry.Ta zdolność środków powierzchniowo czynnych na bazie aminokwasów sprawia, że są one bardzo przydatne w szamponie, barwnikach do włosów, zmiękczaniach włosów, odżywkach włosów, a obecność aminokwasów sprawia, że włosy są silne.
11 Zastosowania w codziennych kosmetykach
Obecnie na całym świecie istnieje rosnące zapotrzebowanie na preparaty detergentowe na bazie aminokwasów.Wiadomo, że AA mają lepszą zdolność do czyszczenia, zdolność do spożywania i właściwości zmiękczania tkanin, co czyni je odpowiednim do detergentów domowych, szamponów, mycia ciała i innych zastosowań.Doniesiono, że amfoteryczny AA pochodzący z kwasu asparaginowego jest wysoce skutecznym detergentem o właściwościach chelatujących. Stwierdzono, że zastosowanie składników detergentów składających się z kwasów N-alkilo-β-aminoetoksy zmniejsza podrażnienie skóry. Podobno preparat z detergentu ciekłego składający się z N-kokoilo-β-aminopropionianu jest skutecznym detergentem dla plam olejowych na powierzchniach metali. Wykazano również, że surfaktant kwasu aminokarboksylowego, C 14 Chohch 2 NHCH 2, ma lepszą detergencja i jest używany do czyszczenia tekstyliów, dywanów, włosów, szkła itp. 2-hydroksy-3-aminopropionowy kwas-N, pochodne kwasu N-acetoacetowego jest znane jako dobre kompleksowe zdolności kompleksowe, a zatem daje stabilność dla bielących się.
Przygotowanie preparatów detergentowych opartych na N- (N'-długa łańcuch acylo-β-alanylo)-β-alanina została zgłoszona przez Keigo i Tatsuya w ich patencie dla lepszej zdolności do mycia i stabilności, łatwego złamania piany i dobrego zmiękczania tkanin. Kao opracował preparat detergentu oparty na N-acyl-1-N-hydroksy-β-alaniny i zgłosił niskie podrażnienie skóry, wysoką odporność na wodę i wysoką moc usuwania plam.
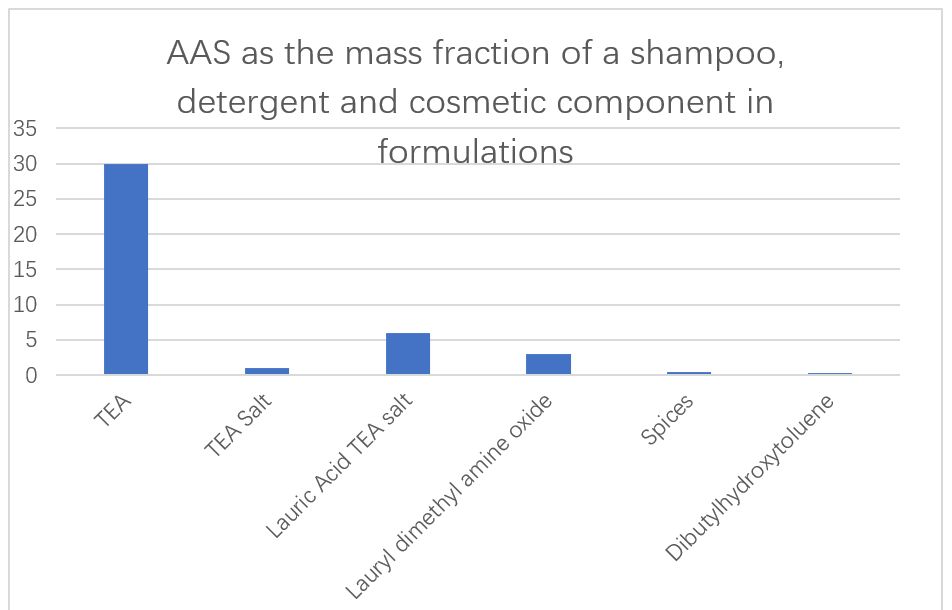
Japońska firma Ajinomoto wykorzystuje niski toksyczny i łatwo degradowalny AA oparty na kwasie L-glutaminowym, L-argininie i L-lizynie jako głównych składnikach szamponów, detergentów i kosmetyków (ryc. 13). Zgłoszono także zdolność dodatków enzymów w preparatach detergentu do usuwania zanieczyszczenia białka. N-acylowe AA pochodzące z kwasu glutaminowego, alaniny, metyloglicyny, seryny i kwasu asparaginowego zostały zgłoszone do ich zastosowania jako doskonałych detergentów ciekłych w roztworach wodnych. Te środki powierzchniowo czynne w ogóle nie zwiększają lepkości, nawet w bardzo niskich temperaturach, i można je łatwo przenieść z naczynia magazynowego urządzenia pienionego, aby uzyskać jednorodne piany.
Czas po: 09-9-2022

